
1. 공정계 합금
2개 성분의 금속이 용해된 상태에서는 균일한 용액으로 되나, 응고 후에는 성분금속이 각각 결정이 되어 분리되며, 2개의 성분금속이 전율 고용체를 만들지 않고 기계적으로 혼합된 조직으로 될 때가 있다. 이와 같은 현상을 공정이라 하고, 이때의 상태도는 아래 그림과 같으며, 이때의 조직을 공정조직(eutectic structure)이라 한다.
합금 m을 냉각시키면 온도 t1, 즉 점 m1에서 응고가 시작되며 금속 A의 초정이 정출(crystal out)된다. 온도가 내려감에 따라 차차 결정의 양이 증가하고, 온도가 t3에 이르렀을 때의 융액과 결정의 양적 관계는 다음과 같다.

여기에서 남은 융액은 이 온도 이하에서 금속 A, B가 동시에 정출하여 응고가 끝난다.
즉, 이 온도에 이르러 남아 있던 융액 중의 두 금속이 동시에 정출하므로 이와 같은 반응을 공정반응(eutectic reaction)이라 하고, 점 E′를 공정점(eutectic point), 합금 E를 공정합금이라 한다.
초정은 초정점에서 공정온도에 이르기까지의 사이에서, 온도가 내려감에 따라 용액중에서 성장을 방해됨이 없이 성장 발달하여 같은 성질의 결정이 모이는데 대하여,공정은 두 금속의 제각기 조그마한 결정의 세밀한 혼합물서, A 금속과 B 금속의 기계적인 혼합물이며, 두 금속이 전연 융합되어지지 않는 것을 말한다.
공정합금의 공정조성과 공정온도를 나타내고 있다. 공정인 Pb-Sb 합금은 각 금속의 비중의 차가 크므로 Sb이 위로 떠올라 조직에 차이가 생기기 쉽다. 이와 같은 현상은 양쪽 금속의 비중의 차이가 클 때, 또 용융합금의 점도가 클수록 그경향이 크므로, 재질이 균일한 공정을 얻으려면 될 수 있는 대로 냉각속도를 빠르게 하는 것이 좋다. Pb-Sb 합금은 베어링 합금(bearing alloy), 활자합금 및 내산합금 등으로 공업적 용도가 넓다.

<공정형 상태도와 냉각곡선>
공정합금은 용융점이 낮고, 일정한 온도에서 용해하므로 연납(soft solder), 저용융합금(fusible alloy) 등에 널리 사용된다.

<공정합금과 공정조성 및 공정온도>
2. 금속간화합물(intermetallic compounds)
금속과 금속 사이의 친화력이 클 때, 2종 이상의 금속원소가 간단한 원자비로 결합 되어 성분 금속과는 다른 성질을 가지는 독립된 화합물을 만드는데 이 화합물을 금속간화합물(intermetallic compounds)이라 하여, 일반적으로 AmBn의 화학식으로 표시한다.
금속간 화합물에는 Fe3C, Cu4Sn, Cu3Sn, CuAl2, Mg2Si, MgZn2 등이 있다.
금속간화합물은 취약(brittle)하며 견고하고, 보통은 융점이 비교적 높으나, 성분의 융점보다도 낮은 온도에서 분해하는 불안정한 것도 있다. 즉 금속간화합물을 만드는 것의 상태도에는 금속간화합물이 자기의 융점을 가질 경우와 금속간화합물이 그 융점 이하에서 분해하기 때문에 자기의 융점을 갖지 않을 경우가 있다.
3. 포정(peritectic)
아래 그림 에서와 같이 금속 A에 다른 금속 B를 첨가하였을 때, 그 용융점은 점차로 내려간다. 반대로 B금속에 A금속을 첨가하면 그 응고점은 점차로 높아져서 E점에서 마주친다. 즉, E점 이상의 온도에서는 α고용체가 안정하고, E점 이하에서는 β고용체가 안정하다.

<포정계 합금의 냉각곡선과 상태도>
즉, 이 합금(alloy)은 E점의 온도에서 양쪽 고용체의 안정도가 다르게 된다. 그러므로 냉각할 때에는 E점에서 용융체 E와 동시에 공존하는 α고용체(G)가 서로 반응을 일으켜 새로운 β고용체(F)을 형성한다. 반대로 가열할 때에는 β고용체가 α고용체(G)와 융액(E)의 2개로 분해한다. 즉 GFE선의 t온도에서는 다음의 반응이 생긴다.

이와 같은 합금을 용융상태에서부터 냉각하면 어떤 일정한 온도에서 정출된 고용체와 함께 이와 공존된 용액이 서로 반응을 일으켜 새로운 다른 고용체를 만든다. 이 반응을 포정반응(peritectic reaction)이라 하고, 이때 새로 만들어진 고체를 포정이라고 한다.
이 같은 형의 포정반응을 하는 합금으로는 Ag-Cd, Ag-Pt, Fe-Au, Ag-Sn, Al-Cu 등이 있다.
3. 편정(monotectic)
이제까지의 합금은 모두 성분 금속이 액상에서는 완전히 용해한 것이었으나, 실제에는 물과 기름같이 액상에서나 고상에서 전연 용해하지 않는 것도 있다. 이 경우는 각 성분이 따로 고유의 응고점에서 응고하므로 아래 그림과 같이 2개의 수평선을 갖는 상태도가 된다. 이러한 합금이 완전분리형 합금인데, 많이 존재하지 않으며 실용화되지 않는다.
그러나 이에 대하여 액상에서 부분적으로 용해하고, 성분에 따라서 2상의 액태로 분리하는 때가 있다. 액태 만에 관해서의 그 상태도는 아래 그림가 그 기본형인데, 그림의 폐곡선(loop)의 의미는 그 밖에서는 M, N의 2성분이 완전히 균일한 액태이나, 원 안에는 2상으로 분리되는 것을 나타낸다. 즉, k조성의 혼합물은 온도 t1이하 및 t3 이상에서는 균일한 1상(단상) 용액이지만 온도 t2에서는 L1과 L2의 2상이 공액분리한다. 이러한 액상분리가 응고과정 중에 일어날 때에도 상태도에는 특유한 형이 나타나는데 이것이 편정 또는 단정형(monotectic)이라고 한다.
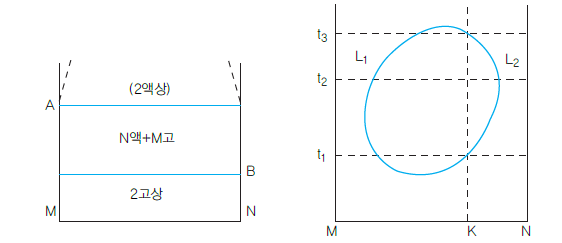
<완전 분리형 상태도, 부분 분리형 상태도>
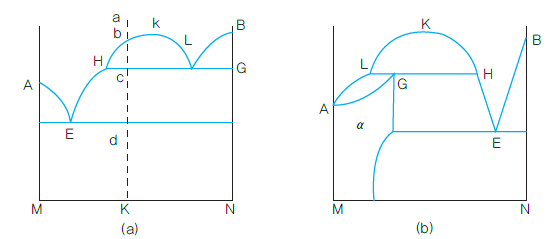
<편정 반응 상태도>
액상분리곡선이 순공정형의 액상선과 L점에서 만났다고 하면, 액상 L은 공정액상선에 관하여 고상 G와 공액이며, 액상분리곡선에 관하여 액상 H와 공액이다. 따라서 이 온도에서는 2액상과 1고상이 3상이 공존하며, L
을 통하는 무변계의 편정수평선 HLG가 얻어진다. 구역 HkL 안에 있어서는 2종의 액태가 공존하며, k점은 임계점(critical point)이고, 이 이상의 온도에서는 균일한 액태이다.
수평선 HLG의 반응은 다음과 같다.

이와 같이 일종의 용액에서 고상과 다른 종류의 용액을 동시에 생성하는 반응을 편정반응(monotectic reaction)이라 하며, 이 형의 합금으로는 Cr-Cu, Bi-Zn, Ag-Ni 등이 있다.
4. 고상변태
공업적으로 사용되는 합금 중에는 고체 상태에서 상변화를 가지는 합금이 대부분이다.
2개의 성분 또는 금속간 화합물이 동소변태를 가질 때에는 응고 후 이것을 냉각하면 냉각 도중에 그 변태에 해당되는 온도에서 발열작용을 하게 되므로, 그 상태도 상에서 직선 또는 곡선으로 변화가 나타나며, 고체 내에서 다른 고체로 변태할 때에도융체에서 생기는 경우와 같아 반응은 상당히 느리나, 상태도의 모양에는 거의 차이가
없다.
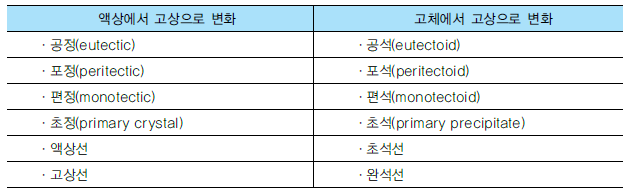
<액상과 고상에서의 상변화 비교>
출처 : 한국산업인력공단 금속재료 자료 활용
'ㆍ공부 자료 > ㆍ금속재료' 카테고리의 다른 글
| 12. 금속재료-결정구조 (3) | 2024.08.02 |
|---|---|
| 11. 금속재료-결정구조 (45) | 2024.07.28 |
| 9. 금속재료-금속조직 (5) | 2024.07.22 |
| 8. 금속재료-금속조직 (0) | 2024.07.21 |
| 7. 금속재료-금속조직 (0) | 2024.07.21 |



